Studie o bezpečnosti přirozeně se vyskytujícího vzácného HHC (hexahydrokanabinol)
Souhrn neklinického hodnocení bezpečnosti in vitro konopného derivátu (R/S)-hexahydrokanabinolu ((R/S)-HHC)
Studie byla zveřejněna 7. září 2022.
Arianna Collins, Tesfay Tesfatsion, Giovanni Ramirez, Kyle Ray, Westley Cruces
Cannabis Science and Technology, září 2022, svazek 5, číslo 7. Stránky: 23–27.
Předmluva
V předkládané práci se autoři snaží podrobněji porozumět přirozeně se vyskytujícímu vzácnému kanabinoidnímu analogu, hexahydrokanabinolu (HHC), a to zkoumáním bezpečnostního profilu s využitím laboratoře třetí strany, která získala preklinické údaje o bezpečnostním profilu in vitro (tj. ve zkumavce). Účelem těchto studií je prokázat, že hexahydrokanabinol (HHC) je bezpečný pro potenciální lidskou spotřebu.
V prováděné studii zkoumáme bezpečnostní profil HHC, přičemž využíváme laboratoř třetí strany k získání preklinických údajů o bezpečnostním profilu in vitro, které se týkají cytotoxicity kardiomyocytů; prostřednictvím genu, který je často označován jako „human Ether-à-go-go-Related Gen“ (hERG – neboli gen příbuzný lidskému éteru); hepatocytů a plicních fibroblastů.
hERG (1) je gen, který kóduje protein známý jako Kv11.1 – alfa podjednotku draslíkového iontového kanálu. Tento iontový kanál (označovaný jednoduše jako „hERG“) je nejznámější pro svůj podíl na elektrické aktivitě srdce: kanál hERG zprostředkovává repolarizační proud v srdečním akčním potenciálu, který pomáhá koordinovat srdeční tep.
Předchozí studie HHC zanedbávají základní strukturu HHC (2) a testují syntetické deriváty a různé analogy.
Účelem těchto studií je prokázat HHC jako bezpečný kanabinoid pro potenciální lidskou spotřebu. Preklinická hodnocení HHC nenaznačila žádné problémy s bezpečností pro srdce prostřednictvím údajů z rychlého náplasťového testu hERG (3). HHC rovněž neprokázal žádnou cytotoxicitu v testu životaschopnosti lidských jaterních hepatocytů. HHC podle údajů in vitro (tj. ve zkumavce) vyvolal potenciální cytotoxické účinky u lidských plicních fibroblastů při překročení koncentrací 10 mM, při přezkoumání údajů je u lidí možná konzumace bez komplikací.
Užívání kanabinoidů se datuje do starověké Číny kolem roku 2 500 př. n. l. (4). Tyto látky, které se vyskytují v přírodě, se používají k rekreačním i léčebným účelům: ke zmírnění bolesti (5), gastrointestinálních problémů (6), roztroušené sklerózy (7), úzkosti (8), rakoviny (9) a dalším. Rozmach užívání konopí po celém světě způsobil, že se provádí stále více studií, jejichž cílem je zjistit léčebné přínosy těchto sloučenin v boji proti některým z nejvíce vysilujících a chronických onemocnění. Cannabis sativa L. produkuje více než 120 minoritních kanabinoidů (10).
Současné a relevantní studie hexahydrokanabinolu (HHC) (11) zahrnují substituované skupiny, jako jsou alkoholy a karbonyly, které ovlivňují cílovou a vazebnou afinitu a mohou představovat rizika, která nejsou široce studována.
My se ve studii naopak zaměřujeme výhradně na HHC, který má methylovou skupinu v poloze C9; nikoliv na jiné funkční skupiny. Vzhledem k tomu, že se tento kanabinoid (HHC) v rostlině přirozeně vyskytuje (i když ve stopovém množství (12,13)), lze jej z konopí a marihuany extrahovat běžnými izolačními metodami, což je ale neefektivní a poměrně nákladný proces. Naše vědecká skupina vyvinula účinný a spolehlivý způsob syntézy a izolace (R/S)-HHC vycházející z D8- a D9-tetrahydrokanabinolu (THC) a zároveň jsme se zaměřili na studium bezpečnosti tohoto vzácného kanabinoidu, mimo jiné včetně studií buněčné životaschopnosti a cytotoxicity.
Materiály a metody
U (R/S)-HHC byly provedeny preklinické studie in vitro. Studie byly provedeny v laboratořích Charles River (životaschopnost buněk); Cleveland, OH (hERG); a Skokie, IL (Amesův test). Všechny studie byly průzkumné a byly prováděny v tzv. Non-GLP laboratorním prostředí.
Poznámka překladatele: Rozdíl mezi prováděním studií „GLP“ a studií „Non-GLP“ spočívá v tom, že studie „Non-GLP“ nevyžadují takovou přísnost jako studie GLP. Ačkoli je GLP zapsána v Úředním registru Spojených států; pro studie metabolismu léčiv in vitro a lékových interakcí se dodržování GLP nevyžaduje. Dodržování požadavků GLP se nevyžaduje u průzkumných studií, základního výzkumu nebo screeningu. GLP se vyžaduje pro extrapolaci na člověka. Studie, které nejsou v souladu s GLP, mohou být vysoce kvalitní pro jakýkoli jiný účel.
Mikrobiální mutageneze
Amesův test je jedním z nejčastěji používaných testů v toxikologii. Tímto testem se testují téměř všechny nové farmaceutické látky a chemické látky používané v průmyslu. Test reverzní mutace Salmonella typhimurium je bakteriální krátkodobý test pro identifikaci karcinogenních látek, který využívá mutagenitu u bakterií jako koncovou hodnotu. Amesův test slouží ke stanovení karcinogenního a mutagenního potenciálu chemických sloučenin. Sleduje se zde schopnost testované látky způsobit reverzní mutaci a obnovit růst bakterie v médiu bez přídavku histidinu. Pomocí Amesova testu lze identifikovat přímé i nepřímé (například chemické látky, které vyžadují metabolickou aktivaci) mutageny.
Hodnocení proudu hERG pomocí analýzy Patch Clamp
Jedním z nejčastějších nežádoucích vedlejších účinků, které vedou k selhání léků, jsou srdeční arytmie. Tato selhání většinou souvisí se schopností léku inhibovat srdeční draslíkový kanál hERG. Inhibice proudu hERG způsobuje prodloužení intervalu QT, což má za následek potenciálně smrtelnou komorovou tachyarytmii zvanou Torsade de Pointes (poznámka: interval QT je úsek na elektrokardiogramu [EKG], který představuje dobu, za kterou elektrický systém vystřelí impuls přes komory a poté se dobije).
Pro vyhodnocení předpokládaných kardiovaskulárních účinků bylo důrazně doporučeno včasné vyhodnocení toxicity hERG, například regulačními agenturami, jako je americký Úřad pro kontrolu potravin a léčiv (FDA) a Evropská agentura pro léčivé přípravky (EMA).
Test životaschopnosti buněk s použitím lidských plicních fibroblastů
Test životaschopnosti buněk se používá k měření metabolické aktivity buněk jako ukazatele životaschopnosti, proliferace a cytotoxicity buněk. Luminiscenční test buněčné životaschopnosti CellTiter-Glo je homogenní metoda stanovení počtu životaschopných buněk v kultuře, založená na kvantifikaci přítomného adenosintrifosfátu (ATP), který je ukazatelem metabolicky aktivních buněk.
Test životaschopnosti buněk s použitím lidských hepatocytů na kultivačních destičkách
Podobně jako u plicních fibroblastů byl ke stanovení potenciální jaterní toxicity (R/S)-HHC in vitro použit vysoce citlivý test životaschopnosti buněk ATP CellTiter-Glo Luminescent. Testovaná sloučenina ([R/S]-HHC) a kontrola (terfenadin) byly testovány v rozmezí koncentrací 0,05 až 50,0 µM na buněčnou životaschopnost (cytotoxicitu) v lidských hepatocytech.
Experiment
(R/S)-HHC
Reaktor o objemu 5 l vybavený zpětným chladičem a adiční nálevkou byl po dobu 15 minut proplachován argonem. Pd/C (10 % hmotnostních) byl do reakce pomalu přidáván pomocí práškové nálevky za přítomnosti argonu. Poté byl reaktor proplachován argonem po dobu 15 min.
Ethanol (200 ml) byl přidáván pomalu, aby se zabránilo jiskření rozpouštědla. Směs D8- a D9-THC (100 g, 318 mmol) byla rozpuštěna v ethanolu (100 ml). Roztok byl přidán do reaktoru s argonem a proplachován po dobu 15 min. Poté byla atmosféra argonu zastavena a byla zavedena atmosféra vodíku (1 bar).
Reakce byla až do dokončení míchána při 25 °C pomocí vysokoúčinné kapalinové chromatografie (HPLC). Po dokončení byla reakce proplachována argonem po dobu 20 min. Reakční směs byla filtrována přes 1-3 µm filtrační papír na Buchnerově nálevce a poté byl roztok zakoncentrován ve vakuu. Surový olej se poté rozpustil v hexanu a přečistil nad oxidem křemičitým (0-5 % EtOAc).
Frakce, které nás zajímaly, byly zakoncentrovány ve vakuu a poté vydestilovány za vzniku bezbarvého až světle žlutého oleje se třemi sloučeninami s podobnými poměry m/z. HPLC (C18): 7,940 min, 8,141 min, 8,395 min LRMS: [M+1]+ 317. 1H NMR (500 MHz, CD3CN) δ 0.89, 0.93, 1.18, 1.30, 1.43, 1.53, 1.62, 2.06, 2.38, 2.42, 2.60, 3.06, 6.08, 6.68.
Konečný produkt byl izolován a 99,9 % (R/S)-HHC je znázorněno na obrázku 1. Dále byla provedena analýza 1H nukleární magnetické rezonance (NMR) a plynové chromatografie s hmotnostní spektrometrií (GC-MS) za účelem stanovení struktury (R/S)-HHC, jak je znázorněno na obrázcích 2 a 3.
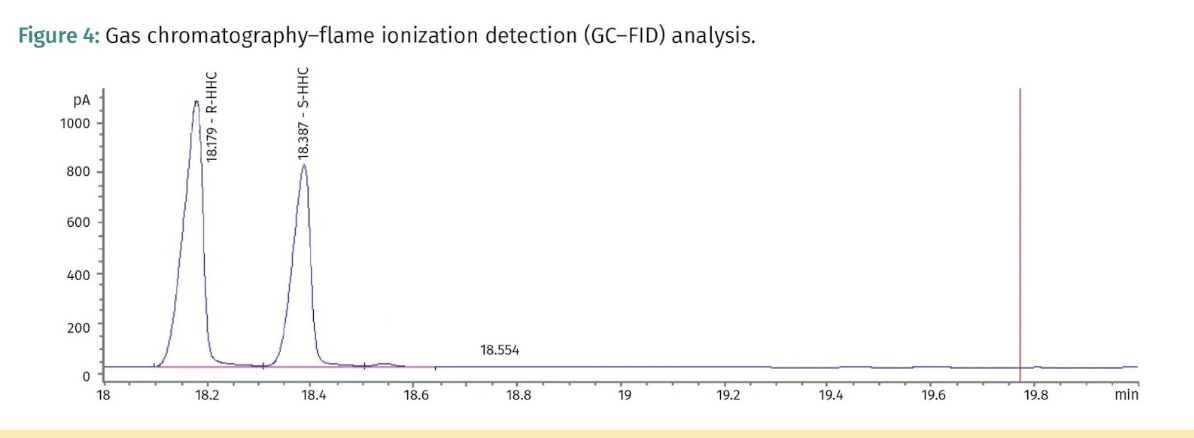
Výsledky a diskuse
Test genotoxicity
Mikrobiální mutageneze
Byl hodnocen potenciál (R/S)-HHC indukovat reverzní mutace u kmenů Salmonella typhimurium TA98, TA100, TA1535 a TA1537 a kmene E. coli WP2 uvrA s metabolickou aktivací i bez ní. Deskový inkorporační screening pro (R/S)-HHC byl testován duplicitně s kmeny TA98, TA100, TA1535, TA1537 a WP2 uvrA v přítomnosti a nepřítomnosti systému metabolické aktivace (fenobarbital/5,6-benzoflavonem indukovaná mikrosomální frakce S9 potkaních jater) v dávkách 1, 5, 10, 50, 100, 500, 1 000 a 5 000 µg/destička.
Pozitivními kontrolami bez metabolické aktivace byly 2-nitrofluoren (TA98, 2,5 µg/destička), azid sodný (TA100 a TA1535, 1 µg/destička), ICR-191 Acridine (TA1537, 0,5 µg/destička) a 4-Nitroquinoline N-oxid (WP2 uvrA, 2,0 µg/destička). Pozitivní kontrolou s metabolickou aktivací pro všechny kmeny byl 2-aminoantracen (2,5 µg/destička pro kmeny Salmonella a 10 µg/destička pro kmen E. coli). Jako vehikulární kontrola byl použit dimethylsulfoxid (DMSO).
(R/S)-Hexahydrokanabinol nebyl mutagenní až do koncentrací ≥ 100 µg/destička u kmene TA1535 bez metabolické aktivace a ≥ 500 µg/destička u kmenů TA98, TA100, TA1537 a WP2 uvrA s metabolickou aktivací i bez ní a u kmene TA1535 s metabolickou aktivací. Údaje z Amesova testu naznačují, že (R/S)-HHC je nemutagenní sloučenina.
Test srdeční bezpečnosti in vitro
Účinek (R/S)-HHC na klonované draslíkové kanály hERG (kódované genem KCNH2 a exprimované v buňkách HEK293) byl zkoumán pomocí QPatch II (Sophion Bioscience A/S), automatického paralelního systému patch clamp. (R/S)-HHC byl vystaven působení hERG v koncentracích 6,25, 12,5, 25 a 50 µM (n ≥ 3).
Doba expozice každé koncentraci testované složky byla minimálně 3 min. Údaje z pozitivní kontroly potvrdily citlivost testovaných systémů na inhibici iontových kanálů.
Souhrn výsledků pro (R/S)-HHC a pozitivní kontroly je uveden v tabulce 1. Z údajů vyplývá, že (R/S)-HHC neblokuje kanály kódované HERG exprimované v buňkách HEK293.
Cytotoxicita
(R/S)-HHC a kontrola (chlorpromazin) byly testovány v rozmezí nominálních koncentrací 0,156 až 50,0 µM na buněčnou životaschopnost (cytotoxicitu) u lidských plicních fibroblastů. U plicních fibroblastů byla IC50 pro (R/S)-HHC 14,4 µM a procento cytotoxicity při 50 µM bylo 74,8 %. Kontrolní chlorpromazin vykazoval hodnotu IC50 14,3 µM a 86,4% cytotoxicitu při 50 µM.
Údaje jsou shrnuty v tabulce 2.

V lidských hepatocytech nebyl (R/S)-HHC cytotoxický a IC50 pro (R/S)-HHC nebyla změřena; procento cytotoxicity při 50 µM bylo rovněž velmi nízké (8,9 %), protože jeho reakce byla slabá. Terfenadin vykazoval hodnotu IC50 15,8 µM a 99,9% cytotoxicitu při 50 µM. Údaje jsou shrnuty v tabulce 3.
Výsledky ukázaly, že neexistuje žádný potenciál pro hepatotoxicitu, přičemž výsledky v tomto testu životaschopnosti lidských hepatocytů na podložce byly velmi slabé.

Závěr
(R/S)-HHC získaný od společnosti Colorado Chromatography Labs s využitím jejich patentované technologie prokázal následující výsledky: (R/S)-HHC nebyl mutagenní v genotoxickém testu in vitro (Amesův test). Preklinické hodnocení ve studii hERG patch clamp nenaznačilo, že by (R/S)-HHC měl ohrozit srdeční bezpečnost, což naznačuje, že neexistuje vliv (R/S)-HHC a prodloužení QTc.
Zjištění ve studiích životaschopnosti buněk prokázala potenciální cytotoxické účinky (R/S)-HHC na lidské plicní fibroblasty v koncentracích > 10 µM. (R/S)-HHC nebyl cytotoxický ani poškozující pro lidské jaterní buňky v testu životaschopnosti lidských hepatocytů in vitro (tj. ve zkumavce).
Budoucí využití této sloučeniny lze ještě posunout, protože byla zjištěna určitá mírná toxicita pro plicní fibroblasty, s cílenou remediací molárních koncentrací, stejně jako s možnou derivatizací budoucích sloučenin HHC.
Jako možné protinádorové léčivo (schopné léčit některé druhy rakoviny plic) by mohla být použita buďto původní sloučenina HHC nebo derivatizovaná sloučenina.
Touto úvodní studií životaschopnosti buněk a bezpečnosti poskytujeme důkaz, že ačkoli byla tato sloučenina vyrobena v laboratorních podmínkách (aby se zvýšila produkce tohoto vzácného kanabinoidu, který se obtížně extrahuje), tak je tato sloučenina bezpečná pro konzumaci a může být otevřena ve světě výzkumu, aby se zjistilo, jaké účinky a onemocnění může HHC pomoci léčit (podobně jako jiné druhy kanabinoidů).
Poděkování
K.P.R. a W.C. děkují za podporu při NMR spektroskopii Dr. Jin Hongovi ze společnosti Custom NMR Services, Inc. z Woburnu, MA a za podporu při hmotnostní spektrometrii Dr. Jasperu van Heemstovi z laboratoří KCA v Nicholasville, KY.
Zdroje:
-
A. Garrido, A. Lepailleur, S.M. Mignani, P. Dallemagne, and C. Rochais, Eur. J. Med. Chem.195(112290), 112290 (2020). https://doi.org/10.1016/j.ejmech.2020.112290.
-
D.J. Harvey and N.K. Brown, Pharmacol. Biochem. Behav.40(3), 533–540 (1991). https://doi.org/10.1016/0091-3057(91)90359-a.
-
T.A. Quinn and P. Kohl, Physiol. Rev.101(1), 37–92 (2021). https://doi.org/10.1152/physrev.00036.2019.
-
E.B. Russo, Chem. Biodivers 4, 1614–1648 (2007). doi:10.1002/cbdv.200790144.
-
R. Abalo, G. Vera, A.E. López-Pérez, M. Martínez-Villaluenga, and M.I. Martín-Fontelles, The Gastrointestinal Pharmacology of Cannabinoids: Focus on Motility Pharmacology 90, 1–10 (2012). https://doi.org/10.1159/000339072.
-
M. Iskedjian, B. Bereza, A. Gordon, C. Piwko, and T.R. Einarson, Curr. Med. Res. Opin.23, 17–24 (2007).
-
F.S. Guimaraes, T.M. Chiaretti, F.G. Graeff, and A.W. Zuardi, Psychopharmacology (Berl). 100, 558–559 (1990).
-
L. De Petrocellis, D. Melck, A. Palmisano, T. Bisogno, C. Laezza, M. Bifulco, M., et al. “The Endogenous Cannabinoid Anandamide Inhibits Human Breast Cancer Cell Proliferation.” Proc. Natl. Acad. Sci. U S A. 95, 8375–8380 (1998). doi:10.1073/pnas.95.14.8375.
-
K.B. Walsh, A.E. McKinney, and A.E. Holmes, Front. Pharmacol. 29, (2021). https://doi.org/10.3389/fphar.2021.777804.
-
Y.R. Lee and L. Xia, Tetrahedron Lett. 49, 3283 (2008).
-
S.P. Nikas, S.O. Alapafuja, I. Papanastasiou, C.A. Paronis, V.G. Shukla, D.P. Papahatjis, A.L. Bowman, A. Halikhedkar, X. Han, and A. Makriyannis, Journal of Medicinal Chemistry 53(19), 6996–7010 (2010). https://doi.org/10.1021/jm100641g.
-
J. Basas-Jaumandreu, and F.X.C. de las Heras, Planta Med. 86(5), 338-347 (2020).
-
R. Adams, Marihuana Active Compounds, US Patent No 2,419,937, May 6, 1947.
Zdroj na originál provedené studie naleznete tady.